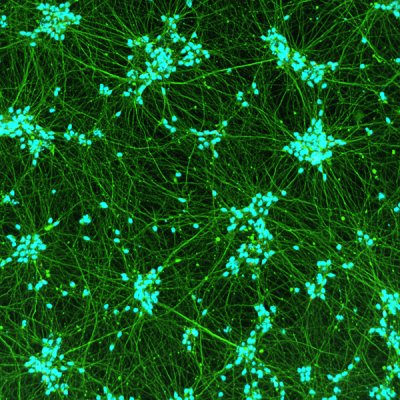
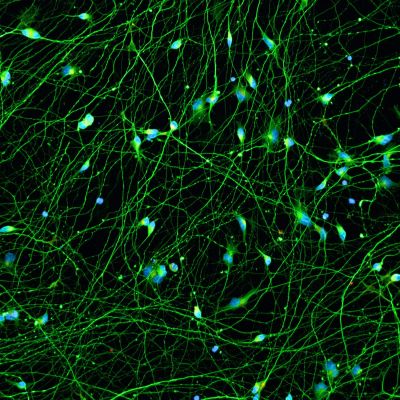
Quick-Neuron™ GABAergic - mRNA Kit
| Short Description | This kit differentiates human pluripotent stem cells into GABAergic neurons in 10 days using synthetic mRNA. |
|---|---|
| Product Components | Small: QNG-mRNA, Component N, Component P, Component G1, Component G2, and Coating Material A, Large: QNG-mRNA, Component N, Component P, Component G1, and Component G2 |
| Storage Conditions | mRNA should be stored at -80°C. All other components can be stored at -20°C or -80°C. |
| Product Use | This product is for research use only. It is not approved for use in humans or for therapeutic or diagnostic use. |
| Differentiation Method | Transcription factors delivered by synthetic mRNA |
| Cell Type | GABAergic Neurons |
| Shipping Conditions | Dry ice |
| Shelf Life | 1 year |
エリクサジェン・サイエンティフィック社が販売するヒトiPS細胞由来分化細胞(凍結細胞)はカルタヘナ法対象ですか?
2021年3月26日に開催された第13回 産業構造審議会 商務流通情報分科会 バイオ小委員会 バイオ利用評価ワーキンググループにおいて、センダイウイルスを用いて製造された当社分化細胞はカルタヘナ法対象外であることが承認されました。詳細は以下リンクをご参照ください。
エリクサジェン・サイエンティフィック社が販売するヒトiPS細胞由来分化細胞(凍結細胞)のウイルス否定情報を教えてください。
CIRMのFAQ(https://www.fujifilmcdi.com/cirm-faqs/)”What testing is perfomed on the samples?"の項目、 もしくはCIRMの論文(https://doi.org/10.1016/j.scr.2019.101671)の記述をご参照下さい。 株ごとの情報はhPSC.reg(https://hpscreg.eu/browse/provider/873)よりご確認下さい。
分化誘導にはどのような転写因子が使われていますか?
当社独自に発見した情報を含むため、知的財産権の保護対象となります。申し訳ございませんが開示することはできません。
1日目に細胞がウェルの中央に凝集して接着していた場合はどうしたらいいですか?
mRNAを用いた分化誘導においては、このような場合は分化効率が非常に低いことが予想されるため、分化誘導を始めることはお勧めできません。Mesendoderm RNAを含むmRNAベースの分化誘導を成功させるには、細胞がウェル内に均一に分布している必要があります。細胞が凝集して接着してしまう原因としては、プレートを振りすぎたことにより細胞が浮いている間にウェルの中央に溜まってしまった可能性などがあります。場合によってはCO₂インキュベーター内に入れる前に、振動のない平らなベンチトップに15分間放置してください。
1日目の培養で、ウェルの中心部にのみ細胞が接着し、周辺部には接着していない場合、どうすればよいですか?
ウェルの中心部に細胞が凝集(=播種時の手技の問題)していなければ、コーティングの問題が考えられます。なお、Nunc社製の4ウェルプレートでは、当社のコーティング条件を適用すると、ウェルの周辺部に細胞が定着しないことがあることが確認されています。次回は、24ウェルプレートを使用して以下のことをお試しください。1)コーティング剤を入れたプレートを37℃で2時間インキュベートする代わりに、4℃で一晩インキュベートする。2)コーティング完了後、上澄み液を完全に吸引せずウェル底面を覆う程度に上澄み液を残すことで乾燥するのを防ぐ。
指示通りに細胞を播種しましたが、1日目の培養結果がユーザーガイドに掲載されているものよりも細胞密度が少ないのはなぜですか?
hiPS細胞を回収する際にダメージを受けた可能性があります。ユーザーガイドの指示に従って、Solution D1を使用した後、数回のピペッティング操作を行うだけで、hiPS細胞が剥離されるのが理想的です。ピペッティングを15回行っても培養されているすべての細胞が剥離しない場合、さらにピペッティングをしようとはせず、剥離した細胞だけを回収してください。代わりに培養液をPBSでリンスし、再度Solution D1処理を行い、インキュベーション時間を長くしてください(最大20分まで)。次回は、ディッシュ/ウェルをコーティングするために使用される基質の濃度を50-70%に下げてください。
培養1日目にコロニーが丸くなっているように見えるのはなぜですか?
Coating Material Aを室温で希釈したか、室温のPBSで希釈した可能性があります。使用前に、「Coating MateriaA」と「PBS」の両方を氷上で冷やしてから希釈してください。
GeltrexやMatrigelをhPSC培養のコーティング基材として使用できますか?
当社のキットはこれらの基質に最適化されていません。ただし、ご使用のhiPS細胞の分化プロトコルがすでにそれらの基質に最適化されている場合は、当社の保証外使用になりますが当社のキットと併用していただくことは可能です。
hiPS細胞を回収した後、凝集塊がたくさんできるのはなぜですか?
hiPS細胞を回収した後、細胞をチューブ内に5分以上放置させないでください。それ以上放置すると細胞の塊ができる原因になります。細胞塊の形成はセンダイウイルスの感染の妨げになることがあります。感染にはシングルセルが最適です。
Solution D1処理だけでは細胞が剥離できず、スクレイピングが必要なのですが、なぜですか?
ディッシュ/ウェルのコーティングに使用した基質の濃度が高すぎると、Solution D1の処理で細胞を剥離するために10分以上(最大20分まで)のインキュベーションが必要になります。次回からは、コーティング基質の濃度を50〜70%に下げてください。
分化キットでは、なぜhiPS細胞をStemFitやStemFlexの条件で維持する必要があるのですか?
hiPS細胞は、分化の前にシングルセルでの継代に適応する必要があります。当社のプロトコルはStemFit/StemFlexでのみテストされていますので、他のiPS細胞用培地での結果を保証することができません。
キットを使用する前に、どのくらいの期間、hiPS細胞を維持する必要がありますか?
分化を開始する前の細胞は、典型的なhiPS細胞の形態(細胞質領域が小さく、細胞が密に詰まった丸いコロニー)を示し、自発的に分化する細胞が少なく、正常な増殖率(例:1日2倍になる)で安定して培養されている必要があります。そのため、分化させる前に凍結ストックから融解後少なくとも14日間は培養し、培養中は80%以上のコンフルエントに達しないように適宜継代を行ってください。
エリクサジェン・サイエンティフィック製品の使用にはライセンス契約が必要ですか?
いいえ。当社の分化キットやiPS細胞由来分化細胞を使用するのに、追加ライセンスやMTA(Material Transfer Agreement)は必要ありません。ただし、これらの製品は研究用に限ります。 一方、mRNAのCDMOサービスについては個別の案件で異なりますので、問い合わせください。