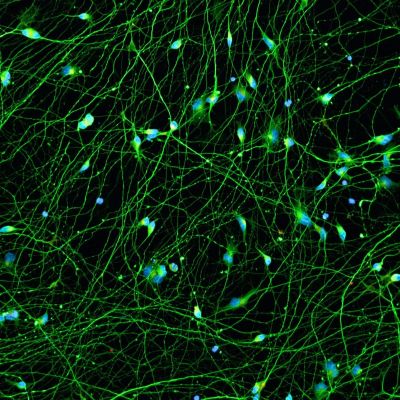
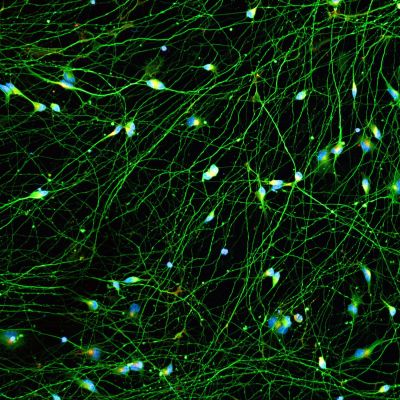
Quick-Neuron™ Excitatory - SeV Kit
| Short Description | This kit differentiates human pluripotent stem cells into excitatory neurons in 10 days using Sendai virus. |
|---|---|
| Product Components | Small: QN-SeV, Component N, Component P, Component G1, Component G2, and Coating Material A, Large: QN-SeV (undiluted), Component N, Component G1, Component G2, and Component P |
| Storage Conditions | SeV should be stored at -80°C. All other components can be stored at -20°C or -80°C. |
| Product Use | This product is for research use only. It is not approved for use in humans or for therapeutic or diagnostic use. |
| Differentiation Method | Transcription factors delivered by Sendai virus vector |
| Cell Type | Excitatory Neurons |
| Shipping Conditions | Dry ice |
| Shelf Life | 1 year |
ポスター
Functional and pharmacological evaluation of iPSC-derived astrocytes generated by a rapid differentiation method (Society for Neuroscience 2022)
Functional evaluation of iPSC-derived astrocytes generated by a rapid differentiation method (Neuro2022 in Japan)
Using Human iPSC-derived Neurons and Astrocytes Produced by Transcription Factor-Based Differentiation Protocols to Generate Models to study Alzheimer’s Disease in vitro (Society for Neuroscience 2022)
Generation of Alzheimer’s Disease Model Using Human iPSC-derived Neurons and Astrocytes Produced by a Transcription Factor-Based Differentiation Protocol (Neuro4D 2022)
Separation of drug effects in human iPS cell-derived neurons using MEA system (Society for Neuroscience 2019)
Evaluation of Ready-to-Use Quick-Neuron™ Plate - MEA 48 (Society for Neuroscience 2021)
MEA assay with human iPSC-derived neurons generated by a rapid differentiation method (Safety Pharmacology Society 2020)
Application of Rapid iPSC Differentiation to Neurotoxicity Assays (Safety Pharmacology Society 2020)
アプリケーションノート
Human iPSC-derived excitatory neurons and astrocytes differentiated by Quick-Tissue™ technology for functional drug screening on MEAs
Visualizing Neurite Outgrowth by Lentiviral Transduction of Fluorescent Proteins into Human iPSC-derived Excitatory Neurons
Genetic and Functional Profiling of hiPSC-derived Excitatory Neurons Differentiated by Quick-Neuron™ Technology
エリクサジェン・サイエンティフィック社が販売するヒトiPS細胞由来分化細胞(凍結細胞)はカルタヘナ法対象ですか?
2021年3月26日に開催された第13回 産業構造審議会 商務流通情報分科会 バイオ小委員会 バイオ利用評価ワーキンググループにおいて、センダイウイルスを用いて製造された当社分化細胞はカルタヘナ法対象外であることが承認されました。詳細は以下リンクをご参照ください。
エリクサジェン・サイエンティフィック社が販売するヒトiPS細胞由来分化細胞(凍結細胞)のウイルス否定情報を教えてください。
CIRMのFAQ(https://www.fujifilmcdi.com/cirm-faqs/)”What testing is perfomed on the samples?"の項目、 もしくはCIRMの論文(https://doi.org/10.1016/j.scr.2019.101671)の記述をご参照下さい。 株ごとの情報はhPSC.reg(https://hpscreg.eu/browse/provider/873)よりご確認下さい。
分化誘導にはどのような転写因子が使われていますか?
当社独自に発見した情報を含むため、知的財産権の保護対象となります。申し訳ございませんが開示することはできません。
1日目に多くの浮遊細胞や細胞の残骸が見られるのはなぜですか?
hiPS細胞を採取する際に機械的に回収したか、ピペッティングの回数が多すぎた、または勢いが強すぎたことでダメージを受けた可能性があります。Solution D1で処理したhiPS細胞は、15回までのピペッティングで剥離し、スクレイピングは行わないようにしてください。
1日目の培養で、ウェルの中心部にのみ細胞が接着し、周辺部には接着していない場合、どうすればよいですか?
ウェルの中心部に細胞が凝集(=播種時の手技の問題)していなければ、コーティングの問題が考えられます。なお、Nunc社製の4ウェルプレートでは、当社のコーティング条件を適用すると、ウェルの周辺部に細胞が定着しないことがあることが確認されています。次回は、24ウェルプレートを使用して以下のことをお試しください。1)コーティング剤を入れたプレートを37℃で2時間インキュベートする代わりに、4℃で一晩インキュベートする。2)コーティング完了後、上澄み液を完全に吸引せずウェル底面を覆う程度に上澄み液を残すことで乾燥するのを防ぐ。
指示通りに細胞を播種しましたが、1日目の培養結果がユーザーガイドに掲載されているものよりも細胞密度が少ないのはなぜですか?
hiPS細胞を回収する際にダメージを受けた可能性があります。ユーザーガイドの指示に従って、Solution D1を使用した後、数回のピペッティング操作を行うだけで、hiPS細胞が剥離されるのが理想的です。ピペッティングを15回行っても培養されているすべての細胞が剥離しない場合、さらにピペッティングをしようとはせず、剥離した細胞だけを回収してください。代わりに培養液をPBSでリンスし、再度Solution D1処理を行い、インキュベーション時間を長くしてください(最大20分まで)。次回は、ディッシュ/ウェルをコーティングするために使用される基質の濃度を50-70%に下げてください。
培養1日目にコロニーが丸くなっているように見えるのはなぜですか?
Coating Material Aを室温で希釈したか、室温のPBSで希釈した可能性があります。使用前に、「Coating MateriaA」と「PBS」の両方を氷上で冷やしてから希釈してください。
SeVと細胞との懸濁液を10分間インキュベートしている間に、オービタルシェーカーを使うことはできますか?
10分間のインキュベーション中に細胞とSeVの入ったチューブを2分ごとにタッピングするのは、細胞が沈降して凝集体を形成するのを防ぐためです。オービタルシェーカーでも同じ効果が得られるのであれば、使用することは可能です。
GeltrexやMatrigelをhPSC培養のコーティング基材として使用できますか?
当社のキットはこれらの基質に最適化されていません。ただし、ご使用のhiPS細胞の分化プロトコルがすでにそれらの基質に最適化されている場合は、当社の保証外使用になりますが当社のキットと併用していただくことは可能です。
hiPS細胞を回収した後、凝集塊がたくさんできるのはなぜですか?
hiPS細胞を回収した後、細胞をチューブ内に5分以上放置させないでください。それ以上放置すると細胞の塊ができる原因になります。細胞塊の形成はセンダイウイルスの感染の妨げになることがあります。感染にはシングルセルが最適です。
Solution D1処理だけでは細胞が剥離できず、スクレイピングが必要なのですが、なぜですか?
ディッシュ/ウェルのコーティングに使用した基質の濃度が高すぎると、Solution D1の処理で細胞を剥離するために10分以上(最大20分まで)のインキュベーションが必要になります。次回からは、コーティング基質の濃度を50〜70%に下げてください。
分化キットでは、なぜhiPS細胞をStemFitやStemFlexの条件で維持する必要があるのですか?
hiPS細胞は、分化の前にシングルセルでの継代に適応する必要があります。当社のプロトコルはStemFit/StemFlexでのみテストされていますので、他のiPS細胞用培地での結果を保証することができません。
キットを使用する前に、どのくらいの期間、hiPS細胞を維持する必要がありますか?
分化を開始する前の細胞は、典型的なhiPS細胞の形態(細胞質領域が小さく、細胞が密に詰まった丸いコロニー)を示し、自発的に分化する細胞が少なく、正常な増殖率(例:1日2倍になる)で安定して培養されている必要があります。そのため、分化させる前に凍結ストックから融解後少なくとも14日間は培養し、培養中は80%以上のコンフルエントに達しないように適宜継代を行ってください。
エリクサジェン・サイエンティフィック製品の使用にはライセンス契約が必要ですか?
いいえ。当社の分化キットやiPS細胞由来分化細胞を使用するのに、追加ライセンスやMTA(Material Transfer Agreement)は必要ありません。ただし、これらの製品は研究用に限ります。 一方、mRNAのCDMOサービスについては個別の案件で異なりますので、問い合わせください。
センダイウイルス(SeV)は危険ですか?
SeVはヒトに対する病原性はなく(ヒトはこのウイルスの自然宿主ではない)、免疫力のある動物では感染が持続しません。さらに、当社のキットで使用しているSeVは、宿主としてヒト多能性幹細胞に導入しても感染性のウイルス粒子を生成せず、また33℃では活性化していますが37℃では不活性化する温度感受性の変異体です。ただし、SeVはエアロゾルや呼吸器分泌物との接触により感染する可能性があり、また感染力も強力です。そのため、ウイルスが粘膜に付着しないように適切な配慮が必要です。当社のSeVを用いたキットは、安全キャビネットまたはクリーンベンチを用いたバイオセーフティーレベル2(BSL-2)の封じ込め下で、適切な個人用保護具を用いて使用する必要があります。万が一、ウイルスが皮膚や目に接触した場合は、多量の水で洗い流して患部を除染し、所属機関のバイオセーフティ委員会の承認を得た安全マニュアルに従って処置ください。
分化後もSeVは活性を維持しますか?
いいえ、当社のキットで使用しているSeVは温度感受性変異体であり、ユーザーガイドにありますように33℃で活性化し、37℃で不活化します。
Quick-Tissue™技術は、ゲノムの遺伝子を改変しますか?
Quick-Tissue™技術で使用されるセンダイウイルス(SeV)はRNAウイルスですので、ゲノムDNAに組み込まれることはありません。、原則として、RNAとして細胞に導入された外来遺伝子は、またmRNAで導入された場合でも、DNAと違い細胞核内に入り込む必要がなく、すぐさま翻訳され発現されます。よって、ゲノム上の遺伝子を変異させることはありません。これは以下の総説で論じられています。Yamamoto, et al. (2009) "Current prospects for mRNA gene delivery." Eur. Eur.J. Pharm Biopharm 71, 484-489.